Anatomie a histologie zubů morčete domácího (Cavia aperea f. porcellus)
Doc. MVDr. Vladimír Jekl, Ph.D., Dip. ECZM; M. Buchtová, A. Mináriková
Souhrn
Morčata domácí jsou často chována jako zvířata v zájmovém chovu. Onemocnění dentice je jedním z nejčastěji diagnostikovaných onemocnění, se kterými je tento druh prezentován k veterinárnímu ošetření. Tento článek shrnuje základní poznatky o anatomickém uspořádání dutiny ústní, dentici a histologické stavbě zubu morčete domácího. Tyto znalosti jsou nezbytné pro volbu optimálních diagnostických metod, terapie a prevence onemocnění dutiny ústní.
Úvod
Morče domácí (Cavia aperea f. porcellus) je druh hlodavce (řád hlodavci – Rodentia) patřícího do čeledi morčatovití (Caviidae) a podřádu dikobrazočelistných (Hystricognathi). Morče je velmi oblíbené jako zvíře chované ze záliby, a proto je také často prezentováno veterinárním lékařům se zdravotními problémy. Nejčastějším onemocněním, se kterým se setkáváme v klinické praxi, je onemocnění dutiny ústní.1 Do této skupiny onemocnění řadíme zejména získaný syndrom onemocnění dentice, iatrogenní malokluzi řezáků, traumata čelistí a zubů, dysplastické změny zárodečné tkáně zubu, parodontitidy a osteodystrofi i saténových morčat.
Pro pochopení specifických patologických procesů dutiny ústní, jejich diagnostiku a následnou terapii je však nezbytná dobrá znalost anatomie dutiny ústní, fyziologie žvýkání a patofyziologie daného problému. Cílem této práce je popis anatomie dutiny ústní a histologické stavby zubů morčete domácího (Cavia aperea f. porcellus).
Dentice
Dentice morčete je monofyodontní, kdy se zuby prořezávají pouze jednou za život a nejsou již nahrazovány druhou generací zubů.2 Nicméně dočasné zuby první generace se u nich zakládají.3 Dočasné premoláry a moláry se prořezávají intrauterinně mezi 43. a 48. dnem březosti, ale jsou resorbovány již 55. den.4 V porovnání s trvalými premoláry a moláry jsou dočasné zuby velmi malé (výška korunky kolem 1 mm) a mají jednodušší strukturu klinické korunky s několika hrbolky. Trvalé premoláry a moláry prořezávají již před jejich narozením a jedinci se narodí již s kompletní trvalou denticí.5,6 Dentici morčat lze tedy charakterizovat jako monofyodontní s jednou sadou trvalých zubů a s prekurzory dočasných zubů.4
Dentice morčat je heterodontní (chrup s tvarově a funkčně uzpůsobenými zuby) a tento druh je řazen mezi Simplicidentata (mají pouze jeden pár maxilárních řezáků).7 Korunky řezáků, premolárů a molárů jsou aradikulární hypsodontní (elodontní). Všechny zuby rostou tedy kontinuálně po celý život zvířete a nemají anatomický kořen.8,9
Zubní vzorec morčete je I 1/1, C 0/0, P 1/1, M3/3 = 20 zubů, kde písmena označují I – řezáky, C – špičáky, P – premoláry a M – moláry.10 Podobně jako ostatní hlodavci nemají morčata vytvořené špičáky.11 Kaudálně je dutina ústní ohraničena slizniční řasou spojující po stranách kořen jazyka a měkké patro – vzniká tak ostium palatale.12 Apikální dvě třetiny zubu jsou umístěny v kostěném alveolu.13 Supragingivální část zubu se nazývá klinická korunka, zatímco subgingivální část je označována jako rezervní korunka.9,14 Dohromady pak tvoří anatomickou korunku.9
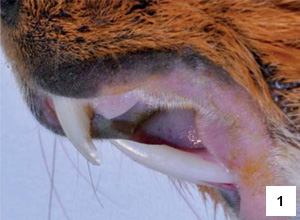
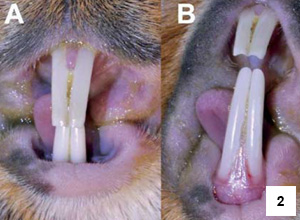
Řezáky
Zakřivení maxilárních řezáků je o polovinu menší než u mandibulárních řezáků.15 Na labiální ploše řezáků je poměrně široká vrstva skloviny bílé barvy (obr. 1 a 2).16 Lingvální plochu řezáků pokrývá, podobně jako u ostatních hlodavců, pouze cement.17,18 Za fyziologických podmínek dochází k tvorbě typické dlátovité okluze řezáků.19 Apex mandibulárních řezáků dosahuje až k okraji apexu prvního moláru. Apex maxilárních řezáků zasahuje k mediálnímu ohraničení prvního premoláru. Mezi řezáky a premoláry je poměrně dlouhá diastema (mezera), která je delší na horní čelisti.15
Premoláry a moláry
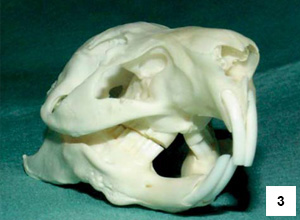
Morčata jsou anisognátní a jejich mandibula je výrazně širší než maxila.19 Mandibulární premoláry a moláry jsou zakřivené s výraznou bukální konvexností a maxilární premoláry a moláry s výraznou palatinální konvexností. Výsledkem je šikmá třecí plocha (obr. 3), která má úhel 30˚ svažující se v distomeziálním a bukopalatinálním směru.8 Linie levé a pravé maxilární zubní arkády se kraniálně sbíhá (do tvaru písmene V) a mezi pravým a levým prvním premolárem je tak úzký kontakt.20 Premoláry a moláry morčete nemají anatomické ani fyziologické odlišnosti, proto jsou v anglosaské literatuře označovány jako tvářové zuby (cheek teeth).19
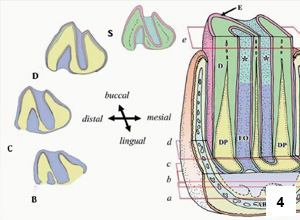
Premoláry a moláry mají dvě podélné, hluboké brázdy na bukální i lingvální straně.21 Tyto brázdy (obr. 4) mají tenkou výstelku ze skloviny a obsahují chrupavce podobný cement, který je kalcifi kován. Na rozdíl od králíků však tvoří okluzní plocha zubů rovinu.20 Mandibulární stolička je v okluzi s odpovídajícím protilehlým maxilárním zubem.
Každý zub se skládá z dentinového jádra, které je pokryté vrstvou skloviny na všech axiálních plochách s výjimkou lingvální plochy mandibulárních molárů a bukální plochy maxilárních molárů.13
Jazyk
azyk je protáhlého tvaru s výrazným torus linguae. Rostrální třetina jazyka je pohyblivá. Povrch jazyka pokrývá velké množství papillae fi liformes. Dále jsou zde dvě pp. vallatae, čtyři skupiny pp. foliatae lokalizovaných na každé straně kaudální části jazyku a množství pp. fungiformes tvořících široce okrouhlý okrsek v kaudální části torus linguaeem>.22 Morčata mají čtyři párové slinné žlázy, a to gl. parotise, gl. zygomaticaem>, gl. mandibularis a gl. sublingualis.16
Žvýkací svaly
Žvýkací sval (m. masseter) je, jako u všech druhů hlodavců, velmi dobře vyvinutý. Proximálně přesahuje přes celý zygomatický oblouk.23 Fossa masseterica není přítomna a žvýkací sval překrývá laterální povrch těla dolní čelisti, větev dolní čelisti a čelistní oblouk.24 Anatomie žvýkacích svalů u morčete byla recentně detailně sumarizována.25,26 Proximální část povrchové části žvýkacího svalu (pars superficialis) odstupuje z malé oblasti na rostrální části kořene jařmového oblouku nebo horní čelisti a je oddělena od hluboké části žvýkacího svalu (pars profunda). Rostrální část hlubokého žvýkacího svalu u morčat chybí.26,27 Pars reflexa úponu žvýkacího svalu je naopak přítomna. M. zygomaticomandibularis je zřetelně separovaný od žvýkacího svalu (m. masseter) a svalu spánkového (m. temporalis). Infraorbitální část zygomatikomandibulárního svalu (pars infraorbitalis m. zygomaticomandibularis) je výrazně vytvořena. Ze svalu spánkového (m. temporalis) je přítomna pouze jeho hluboká část (pars profunda).
Mechanika pohybů čelistí při žvýkání
U morčat rozlišujeme při žvýkání za fyziologických podmínek dva typy pohybů čelistí (bilaterální a unilaterální) během každého žvýkacího cyklu. Bilaterální pohyb je daleko častější než unilaterální. Poměr bilaterálních k unilaterálním žvýkacím cyklům roste od počátečních 2:1 až k poměru 9:1 v závislosti na době žvýkání. Hlavním rozdílem mezi těmito cykly je přechod mezi rychlým otevíráním a rychlým zavíráním dutiny ústní, který je v případě unilaterálního pohybu výrazně prolongován. Při žvýkání dochází u morčat k výraznému rostrokaudálnímu pohybu mandibuly (až 1 cm) s laterální komponentou, která tak umožňuje diagonální pohyb čelistí. Při dalším typu pohybů čelistí – hlodání – dochází k jen minimálnímu laterálnímu pohybu čelistí.28
Atrice
Kontinuální tvorba zubu je v rovnováze s jeho opotřebením během žvýkání. Výsledkem je rovnovážný stav, kdy délka zubu zůstává konstantní.10,29 Maxilární řezáky rostou pomaleji než mandibulární.30,31,32 Rychlost růstu řezáků je u morčete 1,4–1,9 mm za týden u horních řezáků a 1,2 až 2,4 mm za týden u spodních řezáků.33,34 Atrice zubů je vždy přímo úměrná růstu zubů, důsledkem je rychlejší atrice u mandibulárních řezáků.31 Premoláry a moláry rostou rychlostí 0,14 mm za týden.35 Recentně byla popsána pozitivní korelace mezi atricí a růstem řezáků.36 Zjistilo se, že délka zubu je závislá na vnitřním i vnějším abrazivu, kde pouze řezáky horní čelisti jsou ovlivněny i krmením celého sena. Při nezměněných podmínkách atrice jsou premoláry a moláry kompletně nahrazeny novými zubními tkáněmi za 40 dní37 a řezáky za 60 dní.38
Histologická stavba zubu
Sklovina
Sklovina se u morčat vyskytuje na meziální a distální ploše zubu. Sklovinu produkují ameloblasty ektodermálního původu. Na apexu premolárů a molárů se sklovina skládá ze čtyř histologicky zřetelně odlišných vrstev epitelových buněk. Jedná se o vnější sklovinný epitel, hvězdicovité retikulum (stellate reticulum), stratum intermedium a vnitřní sklovinný epitel.
V apikální části zubu se vnější a vnitřní vrstvy sklovinného epitelu k sobě přiloží a formují tzv. cervikální smyčku. Tato oblast se v průběhu dalšího vývoje stane krčkem zubu. Po vytvoření korunky dají buňky cervikální smyčky vzniknout epitelové pochvě a epitelové diafragmě.39,40 Nicméně pojem „cervikální smyčka“ se používá i pro označení epitelové tkáně v koncové části řezáků u hlodavců. 41,42 Pro odlišení této funkčně odlišné a proliferačně velmi aktivní oblasti u řezáků myší od zubů s omezeným růstem byla apikální část řezáků přejmenována na tzv. apikální pupen.43,44,45
V oblasti sklovinného uzlu buněk vnitřního sklovinného epitelu začíná diferenciace ameloblastů, které následně produkují sklovinnou matrix. Diferencované ameloblasty jsou vysoké cylindrické buňky s jádry umístěnými v různé úrovni buňky. Po začátku produkce sklovinné matrix jádra ameloblastů migrují k okraji buňky, tedy se dostávají dále od sekrečního pólu buňky. Po kompletní maturaci skloviny se ameloblasty zmenší a sníží se objem jejich cytoplazmy.13
Buňky stratum intermedium migrují okluzálně společně s ameloblasty. Nejprve mají vzhled jednotlivých oploštěných buněk mezi vnějším sklovinným epitelem a hvězdicovým retikulem. V cervikální smyčce se odděluje a formuje několik vrstev buněk ve tvaru hranolu či jehlanu s velmi malým množstvím cytoplazmy. Při vyzrávání sklovinné matrix buňky str. intermedium obsahují více cytoplazmy a dochází ke kondenzaci nukleárních chromatinových granulí. Po vyzrání sklovinné matrix, str. intermedium se redukuje na jednu vrstvu buněk orientovaných okluzálně, které jsou doprovázeny na jedné straně redukovanými ameloblasty a na druhé straně vysoce vaskularizovanými, volně uspořádanými svazky pojivové tkáně. Tyto svazky hustých vláken přeruší tuto jednu vrstvu buněk str. intermedium a připojí se k zubu pomocí cementových perel.13
Zubovina
Proces formování zuboviny u morčat je podobný jako u ostatních druhů zvířat. V apexu hypsodontních premolárů a molárů jsou odontoblasty diferenciovány z mezenchymových buněk pulpy. Během růstu zubů dochází k následujícím fázím: produkce predentinu, kalcifi kace uvnitř matrix a migrace odontoblastů. Kontinuální ukládání dentinu vede ke kompletnímu uzávěru dřeňové dutiny přibližně od poloviny délky zubu. Od poloviny délky zubu směrem k okluzní ploše zůstávají některé degenerované dřeňové buňky nadále vloženy do nepravidelného dentinu.13
Cement
Popisují se tři odlišné typy cementu: acelulární cement (AC); cementové perly (CP) a chrupavce podobný celulární cement (CC), který je unikátní pro morče a vyskytuje se na stěnách brázd.21,46,47
Povrch apikální části premoláru a moláru je pokryt souvislou vrstvou acelulárního cementu, ke kterému jsou připojeny husté svazky pravidelných periodontálních vláken (PDL) po celé jeho délce, začínající blízko apikálního konce alveolární jamky.48
Rezervní korunky premolárů a molárů jsou rovněž ukotveny v alveolu periodontálními vlákny, které se upínají na cementové perly.48 Cementové perly se vyskytují po celém povrchu skloviny. Výjimkou jsou dvě longitudinální brázdy, které jsou vyplněny chrupavce podobnému typu cementu.48 Perly slouží jako potenciální kotevní místa pro periodontální vlákna. Formování cementových perel začíná v apikální třetině zubní skloviny prostřednictvým úzce lokalizovaného rozpadu skupiny buněk sklovinného epitelu. Matrix cementu je postupně ukládána na sklovinný povrch souběžně se zanořením periodontálních vláken.
Periodontální vlákna premolárů molárů morčat mohou být rozdělena do dvou odlišných oblastí v závislosti na uspořádání vláken, jmenovitě do části související se zuby (tooth-related part, TRP) a na část související s alveolem (alveolus-related part, ARP). Periodontální vlákna TRP jsou připojená k povrchu zubu a jedná se o svazky vláken připojené k cementu, zatímco vlákna ARP jsou lokalizovaná blízko alveolární kosti a mají vlákna připojené k ní. Tyto dvě skupiny vláken se navzájem prolínají v úzké oblasti ve střední zóně zubu.
Závěr
Morče domácí patří mezi běžně chované drobné savce, kteří jsou v současné době často prezentováni veterinárnímu lékaři ke klinickému vyšetření a následné terapii. Prevalence onemocnění dentice je u tohoto druhu poměrně vysoká a u 36,3 % pacientů je diagnostikováno apikální a koronální přerůstání, nerovnoměrná okluze premolárů a molárů nebo změna okluze u řezáků, fraktury zubů nebo strukturální změny zubů a periapikální patologie.1 Pro stanovení správné diagnózy a optimální terapie je tak znalost morfologie ústní dutiny a zubů tohoto druhu nezbytná.
Poděkování: Článek byl podpořen Institucinálním výzkumem FVL VFU Brno 2016/2017 a GA ČR (č. projektu 17-14886S).
Literatura:
- MINARIKOVA, A., HAUPTMAN, K., JEKLOVA, E., KNOTEK, Z., JEKL, V. Diseases in pet guinea pigs: a retrospective study in 1000 animals. Vet Rec. 2015;21: pii: vetrec-2014-103053. doi: 10.1136/vr.103053. [Epub ahead of print]
- WAGNER, J. E. Miscellaneous disease conditions of guinea pigs. In: Wagner, J. E., Manning, P. J. The Biology of the Guinea Pig. New York, Academic Press, 1976:227-234.
- KEIL, A. Grundzüge der Odontologie – Allgemeine und vergleichende Zahnkunde als Organwissenschaft. Berlin; Gebrüder Borntraeger, 1966:192−198.
- STAN, F. Comparative morphological study of oral cavity in rabbits and guinea pigs. Scientific Works. Series C. Veterinary Medicine, 2014;60:27-32.
- AINAMO, J. Prenatal occlusal wear in guinea pig molars. Scand J Dent Res 1971;79:69-71.
- BERKOVITZ, B. K. B. Ontogeny of tooth replacement in the guinea pig (Cavia cobya). Arch Oral Biol.1972;17:711-718.
- CROSSLEY, D. A. Clinical aspects of rodent dental anatomy. J Vet Dent. 1991;12:131-135.
- CROSSLEY, D. A. Clinical aspects of rodent dental anatomy. J Vet Dent. 1995(a);12:131-135.
- WIGGS, R. B., LOBPRISE, H. B. Veterinary dentistry: principles and practice. Philadelphia, Lippincott-Raven, 1997:748.
- KERTESZ, P. A colour atlas of veterinary dentistry and oral surgery. Aylesbury. Wolfe Publishing, 1993:35-50.
- POTTER, G. E., RABB, E. L., GIBBS, L. W., MEDLEN, A. B. Anatomy of the digesive system of Guinea pig (cavia porcellus) In: Potter G. E., Rabb, E. L., Gibbs, L. W., Medlen A. B. Anatomy of the Digestive System of Guinea Pig (Cavia porcellus). Bios, 1956:232-234.
- TIMM, K. I., JAHN, S. E., SEDQWICK, C. J. The palatal ostium of the guinea pig. Lab Anim Sci, 1987;37:801-802.
- HUNT, A. M. A description of the molar teeth and investing tissue of normal guinea pigs. J Dent Res. 1959;38:216-231.
- REITER, A. M. Pathophysiology of dental disease in the rabbit, guinea pig and chinchilla. J Exotic Pet Med 2008;17:70-77.
- CROSSLEY, D. A. Oral biology and disorders of lagomorphs. Vet Clin North Am Exot Anim Pract. 2003;6:629-659.
- QUESENBERRY, K. E., DONELLY, T. M., HILLYER, E. V. Biology, husbandry, and clinical techniques of guinea pigs and chinchillas. In: Quesenberry K. E., Carpenter J. W. Ferret, Rabbit and Rodents. Clinical Medicine and Surgery. St. Louis; W.B. Saunders, 2003:232-254
- BIVIN, W. S., CRAWFORD, M. P., BREWER, N. R. Morphophysiology. In: Baker, H. J., Lindsey, J. R, Weisbroth, S. H. The laboratory rat Vol I. Biology disease. New York, Academic press, 1979:74-104.
- KENT, G. C. Comparative anatomy of the vertebrates. Seventh edition. Dubuque, Wm. C. Brown Publishers, 1987:681.
- CAPELLO, V., GRACIS, M., LENNOX, A. M. Rabbit and Rodent Dentistry Handbook. Zoological Education Network, Lake Worth; Florida 2005:3-18,21-26,65-100.
- BOHMER, E. Dentistry in Rabbits and Rodents. Chichester, West Sussex, England; John Wiley and Sons, Ltd. 2015:5-20, 213-231.
- MORIYAMA, K., SAHARA, N., KAQEYAMA, T., MISAWA, Y., HOSOYA, A., OZAWA, H. Scanning electron microscopy of three different types of cementum in the molar teeth of guinea pig. Arch Oral Biol. 2006;51:439-448.
- BREAZILE, J. C. Anatomy In: The Biology of the Guinea Pig. New York; Academic Press, 1976:53-62
- POPESKO, P., RAJTOVA, V., HORAK, J. A Colour Atlas of Anatomy of Small Laboratory Animals Volume I. In: Rabbit, Guinea Pig. London; Wolfe Publishing Ltd, 1992:164-166.
- CAPELLO, V., LENNOX, A. Advanced diagnostic imaging and surgical treatment of an odontogenic retromasseteric abscess in a Guinea pig. J Small Anim Pract. 2015;56:134-137.
- DRUZINSKY, R. E. Functional anatomy of incisal biting in Aplodontia rufa and sciuromorph rodents – part 1: masticatory muscles, skull shape, and digging. Cells Tissues Organs. 2010;191:510-522.
- COX, P. G., JEFFERY, N. Reviewing the morphology of jaw-closing, musculature in squirrels, rats, and Guinea pigs with contrast-enhanced microCT. Anat Rec 2011;294:915-928.
- WOODS, C. A., HOWLAND, E. B. Adaptive radiation of capromyid rodents: anatomy of the masticatory apparatus. J Mammal 1979;60:95-116.
- JEKL, V., JEKLOVA, E., KNOTEK, Z. (2006) Anatomie dutiny ústní a mechanika pohybu čelistí při žvýkání – II. morče a činčila. Veterinářství 2006;56:486-490.
- OKUDA, A., HORI, Y., ICHIHARA, N., ASARI, M., WIGGS, R. B. Comparative observation of skeletal-dental abnormalities in wild, domestic, and laboratory rabbits. J Vet Dent. 2007;24:224-229.
- SHADLE, A. R. The attrition and extrusive growth of the four major incisor teeth of domestic rabbits. J Mammal 1936;17:15-21.
- VAN FOREEST, A. W. Dentistry in wildlife casualties and exotic animals In: Crossley, D. A., Penman, S. BSAVA Manual of Small Animal Dentistry. S. Cheltenham, British Small Animal Veterinary Association, 1995:209-218.
- WIGGS, N., LOBPRISE, H. Dental anatomy and physiology of pet rodents and lagomorphs. In: Crossley, D. A., Penman, S. BSAVA Manual of Small Animal Dentistry. Cheltenham, British Small Animal Veterinary Association, 1995:84-91.
- SHADLE, A. R., VALVO, N. I., ECKHERT, K. M. The extrusive growth and attrition of the incisor teeth of Cavia cobaya. Anat Rec 1938;71:497-502.
- KAMPHUES, J. Die artgerechte Fütterung von Kaninchen in der Heimtier Haltung. Dtsch Tierarztl Wochenschr, 2001;108:131-135.
- YAGI, Z., MORIMOTO, T., HIDAKA, I. ET. AL. Adjustment of the occlusal vertical dimension in the bite-raised guinea pigs. J Dent Res 2003;82:127-130.
- MÜLLER, J., CLAUSS, M., CORDON, D. ET AL. Tooth length and incisal wear and growth in guinea pigs (Cavia porcellus) fed diets of different abrasiveness. J Anim Physiol Anim Nutr (Berl). 2015;99:591-604 doi: 10.1111/jpn.12226. [Epub ahead of print]
- FISH, E. W., HARRIS, L. J. The effects of vitamin C deficiency on tooth structure in guinea pig. Brit Dent J. 1935;58:3-20.
- BOYLE, P. E., BESSEY, O., WOLBACH, S. B. Experimental production of diffuse alveolar bone atrophy type of periodontal disease by diets deficient in ascorbic acid (Vitamin C). J Am Dent Assn. 1937;24:1768-1777.
- TEN CATE, A. R., SHARPE, P. T., ROY, S., NANCI, A. Development of the tooth and its supporting tissues. In: Nanci, A. Ten Cate’s oral histology. Development, structure and formation. St Louis; Mosby, 2003:79-110.
- NANCI, A. Ten Cate’s histology, Development, structure and formation. St Louis; Mosby, 2008:1-141.
- HARADA, H., KETTUNEN, P., JUNG, H. S., MUSTONEN, T., WANG, Y. A., THESLEFF, I. Localization of putative stem cells in dental epithelium and their association with Notch and FGF signaling. J Cell Biol. 1999;147:105-120.
- KIEFFER-COMBEAU, A., MEYER, J. M., LESOT, H. Cell-matrix interactions and cell-cell junctions during epithelial histo-morphogenesis in the developing mouse incisor. Int J Dev Biol. 2001;45:733-742.
- OHSHIMA, H., KENMOTSU, S., HARADA, H. Use of the term apical bud to refer to the apical and of the continuously growing tooth. Arch Comp Biol Tooth Enamel 2003;8:45-49.
- OHSHIMA, H., NAKASONE, N., HASHIMOTO, E., SAKAI, H., NAKAHURAOHSHIMA, K., HARADA, H. The eternal tooth germ is formed at the apical end of continously growing teeth. Arch Oral Biol 2005;50:153-157.
- HARADA, H., OHSHIMA, H. New perspectives on tooth development and the dental stem cell niche. 2004;67:1-11.
- BERNICK, S. Vascular and nerve supply to the molar teeth of guinea pigs. J Dent Res. 1966;45:249-260.
- HOLMSTEDT, J. O., MCCKUGAGE, S. G. JR., CLARK, J. S., GUEVARA M. J. Osteodentin formation in continuously erupting teeth of guinea pigs. J Dent Res. 1977;56:1569-1576.
- JAYAWARDENA, C. K., TAKAHASHI, N., TAKANO, Y. A unique localization of mechanoreceptors in the periodontal tissue of guinea pig teeth. Arch Histol Cytol. 2002;65:233-244.
- HASHIMOTO, E., NAKAKURA-OHHSHIMA, K., KENMOTSU, S. ET AL. The relationship between the cusp pattern and plural stem cell compartments in Guinea pig cheek teeth by chasing BrdU-labeling. Arch HHistol Cytol 2008;71:317-332.
Adresa korespondujícího autora:
doc. MVDr. Vladimír Jekl, Ph.D., Dip. ECZM
(Small Mammal)
European Recognized Veterinary Specialist in Zoological Medicine
(Small Mammal)
Klinika chorob ptáků, plazů a drobných savců
FVL VFU Brno Brno
Palackého tř. 1946/1
612 42 Brno
e-mail: VladimirJekl@gmail.com